- 1 1. Що таке мурашина кислота
- 2 2. Короткий історичний екскурс
- 3 3. Номенклатура й споріднені сполуки
- 4 4. Фізико-хімічні властивості
- 5 5. Як її отримують: промислові процеси
- 6 6. Зберігання, пакування, матеріали
- 7 7. Контроль якості: що перевіряють
- 8 8. Напрями застосування: від поля до лабораторії
- 9 9. Токсикологія, ризики й перша допомога
- 10 10. Екологічні аспекти
- 11 11. Підготовка робочих розчинів: приклад розрахунку
- 12 12. Типові концентрації та сфери використання
- 13 13. Порівняння з оцтовою кислотою
- 14 14. Взаємодія з матеріалами та корозія: практичні нотатки
- 15 15. Процесна безпека та аналіз ризиків
- 16 16. Якість і специфікації: на що дивляться закупівлі
- 17 17. Кейси застосування (узагальнено)
- 18 18. Часті запитання (FAQ)
- 19 19. Міфи та реальність
- 20 20. Короткі інструкції з безпеки для підприємства
- 21 21. Висновок
1. Що таке мурашина кислота
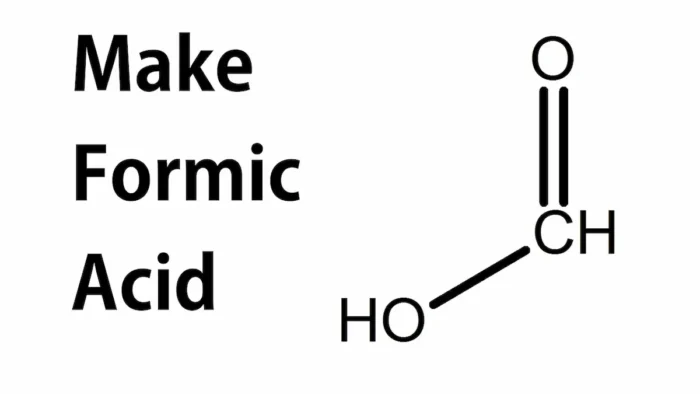
Мурашина кислота (метанова кислота, англ. formic acid; харчова добавка E236) — найпростіша карбонова кислота з формулою HCOOH. Вона природно трапляється в мурах, бджолах, кропиві та деяких плодах, а промислово виробляється в сотнях тисяч тонн на рік. Попри простоту будови, сполука поєднує високу реакційну здатність, корисні консервувальні та антимікробні ефекти й помітну токсикологічну значущість у разі неправильного поводження.
Ключові риси:
- найпростіша карбонова кислота; сильніша за оцтову кислоту;
- добре розчинна у воді та органічних розчинниках;
- відновник; здатна утворювати солі (формиати) й естери;
- у промисловості постачається зазвичай як 85–99% розчин.
2. Короткий історичний екскурс
- 1671: Джон Рей уперше виділив кислоту шляхом дистиляції мурашок (звідси назва).
- XVIII–XIX ст.: відкриття в рослинах і продуктах; опис перших синтетичних підходів.
- XX ст.: становлення масового виробництва як побічного продукту оцтової кислоти та через метилформіат.
- XXI ст.: ренесанс інтересу завдяки ролі носія водню й застосуванню в LC–MS, біоцидних системах, силосуванні.
3. Номенклатура й споріднені сполуки
- Офіційна назва: метанова кислота (Methanoic acid).
- Традиційна: мурашина (Formic acid).
- Солі й ефіри: формиати (натрію, калію, кальцію, амонію; метил- та етилформиат тощо).
- Пероксидна похідна: пермурашина кислота (перформікова) — сильний окисник, застосовується для епоксидування та дезінфекції (з підвищеними вимогами до безпеки).
4. Фізико-хімічні властивості
4.1. Основні параметри
| Параметр | Значення (типові) |
| Формула | HCOOH |
| Молярна маса | 46,03 г/моль |
| Агрегатний стан | Безбарвна рідина з різким запахом |
| Густина (20 °C) | ≈1,22 г/см³ |
| Точка плавлення | ≈+8,4 °C |
| Точка кипіння | ≈+100,8 °C |
| pKa (25 °C) | ≈3,75 |
| Розчинність у воді | Необмежена |
| Здатність до H-зв’язування | Висока (дисоціація, димери) |
Важливі особливості:
- Сильніша за оцтову кислоту (легше знижує pH).
- Виступає відновником (нагрів дає CO; в контрольованих умовах — джерело H₂).
- Схильна до корозії металів і деградації деяких полімерів.
4.2. Реакційна здатність (коротко)
- Естерифікація: HCOOH + ROH ⇄ HCOOR + H₂O (кислотний каталіз).
- Утворення солей: HCOOH + MOH → HCOOM + H₂O.
- Окиснення: до CO₂; відновлення/дегідратація: до CO (термічно/каталітично).
- Джерело «формільної» групи в органічному синтезі (формілювання за участі активувальних систем).
5. Як її отримують: промислові процеси
5.1. Основні методи
- Метилформіатний шлях (карбонілювання метанолу):
CO + CH₃OH → HCOOCH₃ (каталіз NaOMe); далі гідроліз → HCOOH + CH₃OH (рецикл).
Переваги: масштабованість, висока селективність, замкнений цикл метанолу. - Побічний продукт виробництва оцтової кислоти (карбонілювання метанолу з AcOH):
Витягується з маточних розчинів; економіка залежить від попиту на оцтову кислоту. - Окиснення вуглеводнів/метанолу/біосировини (некласичні схеми):
Обмежено використовуються через економіку/селективність. - Гідроліз формаміду (лабораторний/спеціалізований):
Менш рентабельний на великих тоннажах.
5.2. Порівняння підходів
| Підхід | Сильні сторони | Обмеження |
| Метилформіатний | Висока чистота, рецикл розчинника, добре відпрацьована технологія | Вимоги до корозійностійких матеріалів, енергоємність гідролізу/ректифікації |
| Побічний з AcOH | Дешева сировина, інтеграція з існуючими потужностями | Залежність від ацетатного ланцюга, складність сортування |
| Окиснення/біомаршрути | Потенційно «зелені» | Селективність/каталітичні системи, капіталомісткість |
| Гідроліз формаміду | Простота схеми | Нижча економічна привабливість на масштабі |
6. Зберігання, пакування, матеріали
- Концентрації поставки: 85%, 94–96%, 99% (технічні/чисті).
- Тара: каністри/ібс з HDPE; для довгих ліній — нержавіюча сталь AISI 316L.
- Чого уникати: некондиційна вуглецева сталь, мідні сплави, цинк; еластомери типу натуральної гуми без підбору стійкості.
- Умови: прохолодне, вентильоване місце; герметична тара із газообміном за нормами; захист від сонця/джерел тепла.
6.1. Сумісність матеріалів (узагальнено)
| Матеріал | Стійкість |
| PTFE, PFA, PVDF | Висока |
| HDPE, PP | Висока/добра |
| Нерж. сталь 316L | Добра (залежить від температури/конц.) |
| Алюміній, мідь, латунь | Низька/небажана |
| EPDM (спец. компаунди) | Зазвичай добра |
| Нітрил, натуральна гума | Перевіряти окремо |
7. Контроль якості: що перевіряють
- Масова частка HCOOH (титриметрія/кислотне число).
- Домішки: вода (Карл Фішер), метанол/естери (ГХ), метали (ICP).
- Колір/індекс жовтизни, кислотність (pH розчину), стабільність при зберіганні.
8. Напрями застосування: від поля до лабораторії
8.1. Сільське господарство і корми
- Силосування та консервування кормів: інгібування клостридій та дріжджів, швидке зниження pH.
- Кормові добавки/кислотифікатори: формиати (кальцію, натрію) для підтримки кишкового здоров’я тварин.
- Бджільництво: контроль Varroa destructor в контрольованих системах випаровування (лише за інструкціями та локальними регламентами).
8.2. Харчова промисловість
- E236 (консервант): обмежені застосування (напої, маринади тощо) відповідно до національних норм; частіше — у виробництві пакувальних/допоміжних матеріалів і для санітарної обробки.
8.3. Шкіряна та текстильна промисловість
- Дублення, пікелювання, фарбування: контроль pH, фіксація барвників, стабілізація колагену.
8.4. Каучук/латекс та технічні сфери
- Коагуляція латексу й стабілізація емульсій.
- Формиатні солі як високощільні бурові/тампонажні рідини в нафтогазі; деайсинг (K-formate) для ЗПС/доріг.
8.5. Лабораторні та фармацевтичні процеси
- LC–MS мобільні фази (0,05–0,2% HCOOH) для покращення іонізації.
- Органічний синтез: формілювання, відновні трансформації; перформікова кислота для епоксидування (підвищені вимоги до безпеки).
8.6. Енергетика й «зелена» хімія
- Носій водню: каталізатори Ru/Ir/Co/Ni дають H₂ + CO₂ при помірних T; потенціал для буферного зберігання водню.
- Вуглецево-нейтральні цикли: взаємоперетворення CO₂ ⇄ HCOOH (електрохімія/каталіз).
8.7. Дезінфекція та санітарія
- Низькоконцентровані розчини як біоцид/санітайзер у технологічних циклах (не плутати з побутовими засобами; обов’язкові регуляторні дозволи).
9. Токсикологія, ризики й перша допомога
9.1. Маршрути впливу й симптоми
- Контакт зі шкірою/очима: хімічні опіки, сильне подразнення.
- Інгаляція парів/аерозолю: подразнення дихальних шляхів, кашель, головний біль.
- Проковтування: печія, болі в животі, метаболічний ацидоз.
- Особливий випадок — отруєння метанолом: в організмі утворюється формальдегід і мурашина кислота, що може уражати зоровий нерв.
9.2. Загальні принципи першої допомоги
- Шкіра: негайно змити великою кількістю води 15–20 хв, зняти забруднений одяг.
- Очі: промивання водою 15+ хв, звернення по медичну допомогу.
- Інгаляція: свіже повітря, спокій; за симптомів — до лікаря.
- Проковтування: не викликати блювання; терміново звернутися по медичну допомогу.
- Дотримуватись локальних клінічних протоколів; цей текст не замінює професійну консультацію.
9.3. Засоби індивідуального захисту
- Рукавиці (нітрил/бутил/фторкаучук за таблицями хімстійкості), окуляри/щиток, фартух/одяг з кислотостійких матеріалів, локальна вентиляція/витяжка.
- Моніторинг повітря та навчання персоналу — обов’язкові.
10. Екологічні аспекти
- Біорозкладність: зазвичай швидка (мікроорганізми окиснюють до CO₂ та води).
- Токсичність для водних організмів: за високих концентрацій — значуща; бажаний ступінчастий скид і нейтралізація.
- Накопичення/біоакумуляція: низька; сполука полярна й рухома.
- Пожежо- й вибухонебезпека: концентровані розчини — горючі; контролювати джерела займання.
11. Підготовка робочих розчинів: приклад розрахунку
Завдання: приготувати 1,00 л 5,0 % w/w розчину з технічної кислоти 85 % w/w, ρ(85%) ≈ 1,205 г/мл.
- Масу готового розчину приймемо 1000 г (для 1 л за наближенням; за потреби врахувати точну густину).
- Мурашина кислота в ньому: 5,0 % → 50 г HCOOH.
- Необхідна маса 85% кислоти: 50 г / 0,85 = 58,82 г.
- Об’єм 85% кислоти: 58,82 г / 1,205 г/мл ≈ 48,8 мл.
- Долити ≈951 мл води (краще спочатку 900 мл, унести кислоту тонкою цівкою за охолодження та перемішування, довести до мітки).
- Перевірити pH і, за потреби, відкоригувати.
Працювати в ЗІЗ, додавати кислоту у воду, а не навпаки.
12. Типові концентрації та сфери використання
| Концентрація | Де застосовують (приклади) | Коментарі |
| 0,05–0,2% | Мобільні фази LC–MS | Зменшує pH, покращує іонізацію |
| 0,5–3% | Санітарна обробка поверхонь у технологічних циклах | Лише за інструкціями/дозволами |
| 3–10% | Текстиль/шкіра (корекція pH) | Контроль часу контакту |
| 10–30% | Коагуляція латексу, спецпроцеси | Підвищені вимоги до матеріалів |
| 85–99% | Сировина для синтезів, естерифікація | Суворий контроль безпеки |
13. Порівняння з оцтовою кислотою
| Критерій | Мурашина | Оцтова |
| Сила кислоти (pKa↓ = сильніша) | ≈3,75 (сильніша) | ≈4,76 |
| Запах | Різкіший, «пекучий» | Характерний «оцтовий» |
| Відновні властивості | Виражені | Слабкі |
| Корозійність | Вища | Нижча |
| Типові ніші | Силос, біоциди, LC–MS, формілювання | Харчова, побутова, ацетати |
14. Взаємодія з матеріалами та корозія: практичні нотатки
- Вуглецева сталь: швидка корозія, особливо при T>30 °C і високих конц.
- Нержавійка 316L: придатна для трубопроводів/ємностей; уникайте застійних зон.
- Полімери: PTFE/PVDF — «золота стандартна» пара; HDPE — добрий компроміс для тари.
- Ущільнення: EPDM/FKM з підтвердженою хімстійкістю, регулярна інспекція.
15. Процесна безпека та аналіз ризиків
- HAZID/HAZOP: оцінка сценаріїв проливу, нагрівання, змішування з лугами/окисниками.
- Інженерні бар’єри: піддони, локальні відсмоктувачі, датчики парів, спринклерні системи (з урахуванням сумісності матеріалів).
- Операційні процедури: чіткі СОП, навчання персоналу, журнали інцидентів і перевірок.
- Відходи: нейтралізація лугами до pH 6–8, контроль солей формиатів перед скиданням (згідно з місцевими нормами).
16. Якість і специфікації: на що дивляться закупівлі
- Масова частка HCOOH (в %), вода, метанол/ефіри, залізо/метали, індекс кольору, провідність, кислотне число.
- Вимога відстежуваності (лот/сертифікат аналізу), відповідність REACH/GHS/CLP, біоцидні дозволи — залежно від країни й призначення.
17. Кейси застосування (узагальнено)
17.1. Силосування кукурудзи
- Доза визначається сухими речовинами та буферною ємністю маси.
- Мета — швидко опустити pH <4 для пригнічення клостридій.
- У поєднанні з пропіоновою/молочною кислотами досягають синергії (залежно від рецептури).
17.2. LC–MS у фармрозробках
- 0,1% HCOOH у водній фазі + ацетонітрил/метанол.
- Покращує форму піків для основних молекул, сумісна з ESI.
17.3. Деайсинг (K-formate)
- Висока ефективність за низьких температур, менший корозійний вплив порівняно з хлоридами.
- Важлива оцінка впливу на ґрунтові та поверхневі води.
18. Часті запитання (FAQ)
Чи безпечно використовувати E236 у харчових продуктах?
У межах національно дозволених концентрацій — так; виробник зобов’язаний дотримуватися регламентів і виконувати контроль якості.
Чим відрізняються формиати від самої кислоти?
Формиати — солі (наприклад, натрію, кальцію). Вони менш корозійні/леткі, зручні для технічних застосувань (деайсинг, бурові рідини, кормові добавки).
Чи можна замінити оцтову кислоту на мурашину «один до одного»?
Ні. Різниця в силі, леткості, корозійності та запаху вимагає перегляду дозувань і матеріалів.
Чи є мурашина кислота «зеленим» носієм водню?
Потенційно так, якщо її виробництво пов’язане з відновленням CO₂ та застосовуються циклічні каталізатори з низьким вуглецевим слідом.
19. Міфи та реальність
- Міф: «Це слабка побутова кислота, безпечна в роботі».
Факт: концентрат — корозійна, може спричиняти опіки; потрібні ЗІЗ і навчання. - Міф: «У харчах її вже не використовують».
Факт: використання залежить від країни/категорії продуктів; там, де дозволено, лишається корисним консервантом. - Міф: «Формиат калію — те саме, що мурашина кислота».
Факт: інші властивості, інші сфери (деайсинг, бурові ропи).
20. Короткі інструкції з безпеки для підприємства
- Працювати у витяжній шафі/під локальним відсмоктувачем.
- Обов’язкові ЗІЗ: рукавиці, окуляри/щиток, фартух.
- Додавати кислоту у воду.
- Уникати змішування з сильними окисниками та концентрованими лугами без контролю.
- Мати план дій при проливах (зв’язувальні матеріали, нейтралізатори, контейнмент).
21. Висновок
Мурашина кислота — рідкісний приклад «маленької» молекули з «великим» промисловим і науковим значенням. Вона одночасно:
- технологічний інструмент (синтез, регулювання pH, естери, формиати);
- аграрний консервант і біоцидний компонент;
- лабораторний «робочий кінь» для хроматографії;
- кандидат на роль зручного носія водню для низьковуглецевої енергетики.
Разом із цим мурашина кислота вимагає дисципліни безпеки: підбір матеріалів, ЗІЗ, навчання персоналу, контроль викидів і відходів. За дотримання технологічних правил вона лишається ефективним і економічно доцільним інструментом для бізнесу, науки та сільського господарства.

Головний видавець і засновник сайту healthapple.info з 31 травня 2017 року. Редактор статей на сайті.